益生菌加持:让肠菌移植治疗肠炎更“稳”更“准”

文献基本信息
期刊名称:Journal of Advanced Research
影响因子:13.0
学科分区:1区
发表时间:2025年3月
机构:兰州大学生命科学学院 教育部细胞活动与逆境适应重点实验室
DOI:10.1016/j.jare.2025.03.017.
发表在《Journal of Advanced Research》期刊上,标题为“The probiotic enhances donor microbiota stability and improves the efficacy of fecal microbiota transplantation for treating colitis”。研究的主要内容包括:
1. 背景:肠菌移植(FMT)治疗炎症性肠病(IBD)疗效不一,常受限于供体菌群稳定性不足及与受体环境的不匹配。为突破此瓶颈,该研究基于前期工作,选用源自传统发酵食品“浆水”的益生菌Lactobacillus plantarum GR-4。该菌株兼具高抗氧化活性与胆汁酸调节能力,并已证实可显著缓解小鼠结肠炎并修复肠道屏障功能。由此,研究者提出创新性假设:通过GR-4预处理供体,可“改造”并增强其菌群的适应性与稳定性,从而显著提升FMT的治疗效能。
2. 方法:研究团队选用一种具有调节胆汁酸代谢和抗氧化活性的益生菌(Lactobacillus plantarum GR-4),对健康小鼠进行为期3周的喂养,并将其粪便制备为“改良型粪菌”(MFMT),再用于治疗DSS诱导的结肠炎小鼠模型中,比较了MFMT、常规FMT和5-氨基水杨酸(5-ASA)的治疗效果。
3. 结果:
① 益生菌预处理显著增强了供体微生物群的稳定性,提高了短链脂肪酸(SCFAs)水平,增强了供体微生物在肠道中的适应性。
② 与常规FMT和5-ASA相比,MFMT在减轻结肠炎症状、修复肠道屏障、调节炎症因子方面表现出更优越的疗效。
③ MFMT增加了抗炎和免疫调节代谢物的水平,改善了肠道屏障功能,并提高了关键菌株的定植成功率。
该研究首创“益生菌增强型FMT(MFMT)”模式,通过“生态位工程-免疫代谢调控-胆汁酸重塑”三重机制,突破传统FMT依赖供体菌群天然适配性局限,实现供体菌群的精准优化。

解读流程
Interpretation process
01
背景介绍
BACKGROUND
02
研究结果
RESULTS
03
讨论
DISCUSS
01
背景介绍
Background

背景
炎症性肠病(IBD),包括溃疡性结肠炎(UC)和克罗恩病(CD),是一种由肠道菌群失调引起的慢性复发性疾病。近年来,肠菌移植(FMT)因可重建肠道微生态,成为治疗IBD的潜在新策略,尽管其已被FDA批准用于治疗复发性艰难梭菌感染(rCDI),在IBD中的疗效却仍不稳定。目前FMT治疗UC的缓解率仅约45%,主要受制于供体菌群在受体体内定植困难、关键功能菌群丧失,以及供受体菌群不匹配等问题。传统提升策略如“超级供体”筛选或抗生素预处理虽有效,但存在高成本或安全隐患。
为突破这一瓶颈,研究者提出一种创新策略:通过益生菌优化供体本身,而非改变受体。研究团队从西北传统发酵食物“浆水”中筛得植物乳杆菌GR-4,该菌具备强抗氧化力、产酸能力和调节胆汁酸与色氨酸代谢的功能。前期研究已证实其在小鼠结肠炎模型中具有显著抗炎和肠屏障保护作用。
基于此,研究者提出关键假设:通过让供体预先摄入GR-4,可在移植前利用其代谢活动(如产酸、代谢色氨酸)来“重塑”和“强化”供体自身的肠道菌群,提升其定植率和治疗效果。这一策略有望打破传统FMT对天然菌群匹配的依赖,为精准微生态干预开辟新路径。

研究流程图



02
研究结果
Results

GR-4益生菌稳定并优化供体菌群组成
研究者给供体小鼠喂养Lactobacillus plantarum GR-4 三周后,其粪菌发生了关键性变化。主要表现为:①供体小鼠常规岛菌群组成发生显著变化,乳杆菌属(Lactobacillus)、丁酸单胞菌属(Butyricicoccus)等有益菌的丰度增加,而肠球菌属(Enterococcus)等潜在致病菌的丰度减少;②供体小鼠的粪便中丁酸(butyrate)和丙酸(propionic acid)的含量显著增加;③诱导独特的代谢重编程,即GR-4能够高效代谢色氨酸,产生大量免疫调节性的吲哚类物质,如吲哚-3-乳酸(ILA) 和吲哚-3-乙酸(IAA)。
研究者通过体外实验模拟了供体菌群在移植过程中可能遇到的严苛环境(如胃酸和胆盐)。结果显示,经过GR-4改造的供体菌群在模拟胃液和高浓度胆盐(0.6%)中表现出更强的生长和存活能力。
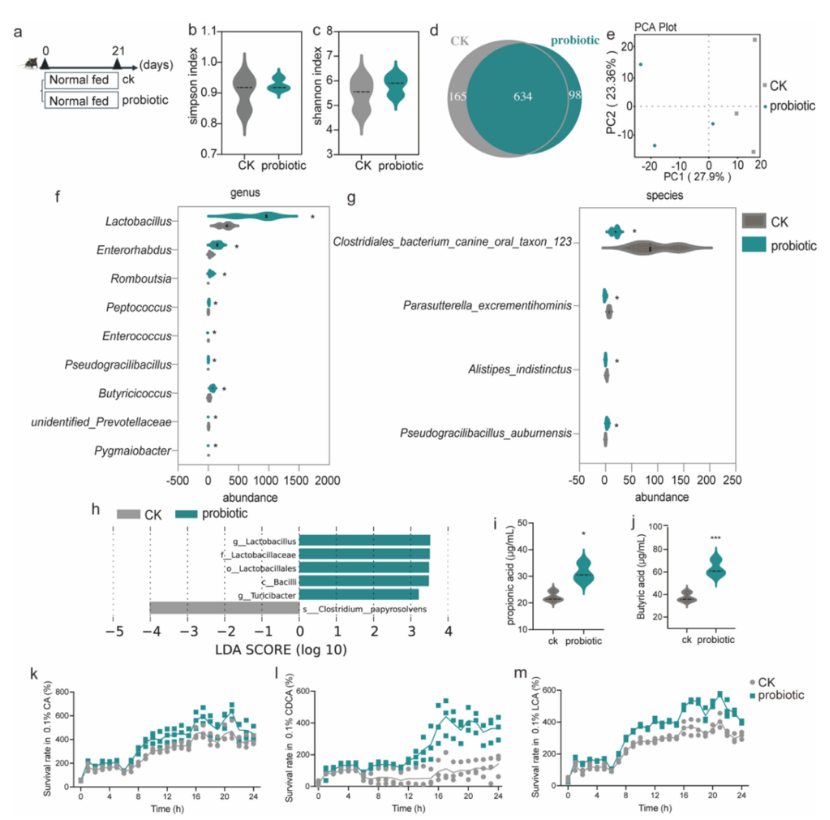
图1 供体粪便微生物群的特征

改良FMT(MFMT)在治疗结肠炎方面显著优于常规FMT和5-ASA
在DSS诱导的结肠炎小鼠模型中,改良FMT(MFMT)展现出卓越的治疗效果。其疾病活动指数(DAI)改善最快,体重下降最少,脾脏指数和结肠缩短等病理指标得到最有效缓解,缓解率高达83.3% ,显著优于常规FMT(50%)和5-ASA。
在机制上,MFMT不仅更有效地降低TNF-α、IL-6等促炎因子,还能特异性激活AHR信号通路,显著提升抗炎因子IL-22和IL-10的水平。此外,MFMT能有效恢复关键的肠道屏障蛋白(如MUC2、Claudin-1)的表达,并逆转DSS诱导的细胞凋亡,从而更全面地保护肠道屏障的完整性。组织学分析进一步证实,唯有MFMT能有效修复结肠隐窝结构并显著增加杯状细胞数量,在组织再生和屏障修复方面具有独特优势。
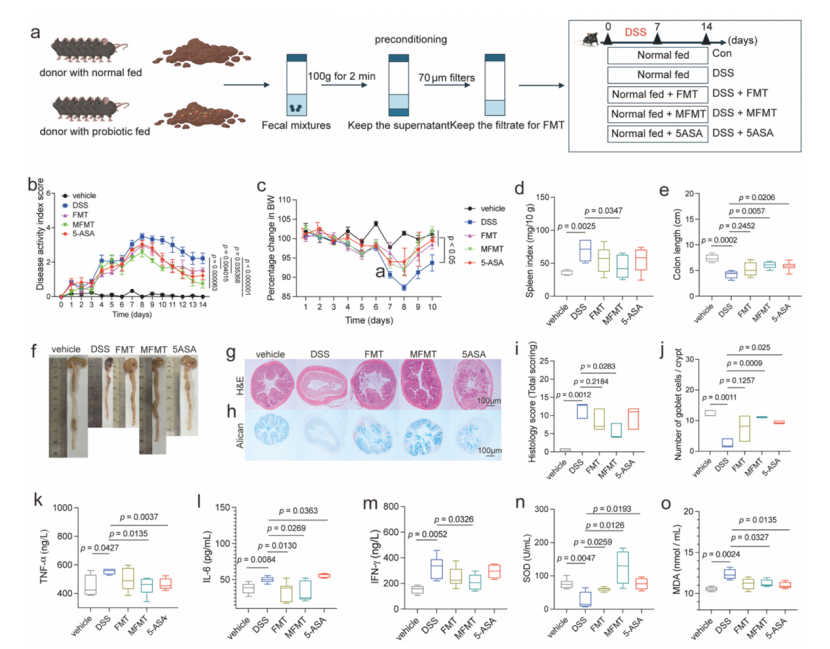
图2 改良FMT减轻了DSS诱导的结肠炎症状
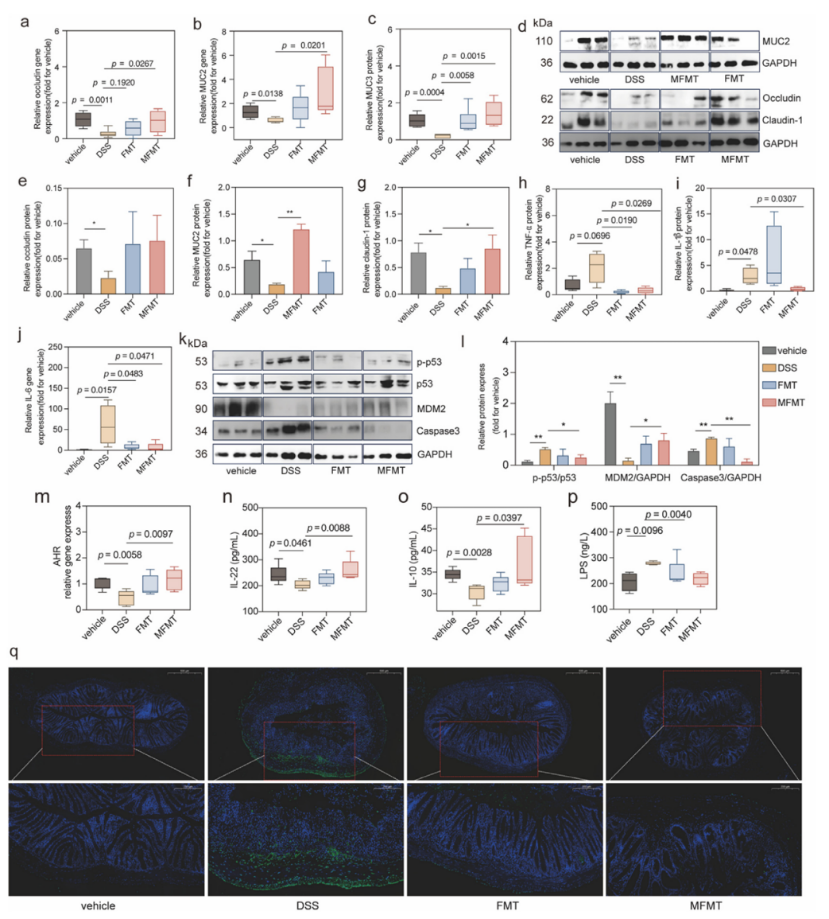
图3 改良供体菌群移植对结肠炎组织中紧密连接蛋白表达和凋亡因子的影响

改良FMT(MFMT)重塑肠道菌群与代谢,实现高效植入
MFMT显著逆转了由DSS处理导致的肠道菌群紊乱和代谢紊乱,显著增加了丁酸生成菌(如Butyricimonas)的丰度,增加了丁酸、丙酸和乙酸的水平,同时恢复了一些关键代谢物(如吲哚衍生物和胆汁酸结合物)的水平。通路分析显示,色氨酸代谢、胆汁酸代谢和精氨酸/脯氨酸代谢是关键代谢通路,与肠道炎症和免疫调节密切相关。
PCA和Sankey图显示,MFMT组受体菌群结构更接近GR-4优化的供体,其植入效率较常规FMT提高1.25倍。MFMT受体中富集更多供体来源的菌株(如Butyricicoccus、Ruminococcus flavefaciens、Lachnoclostridium)。
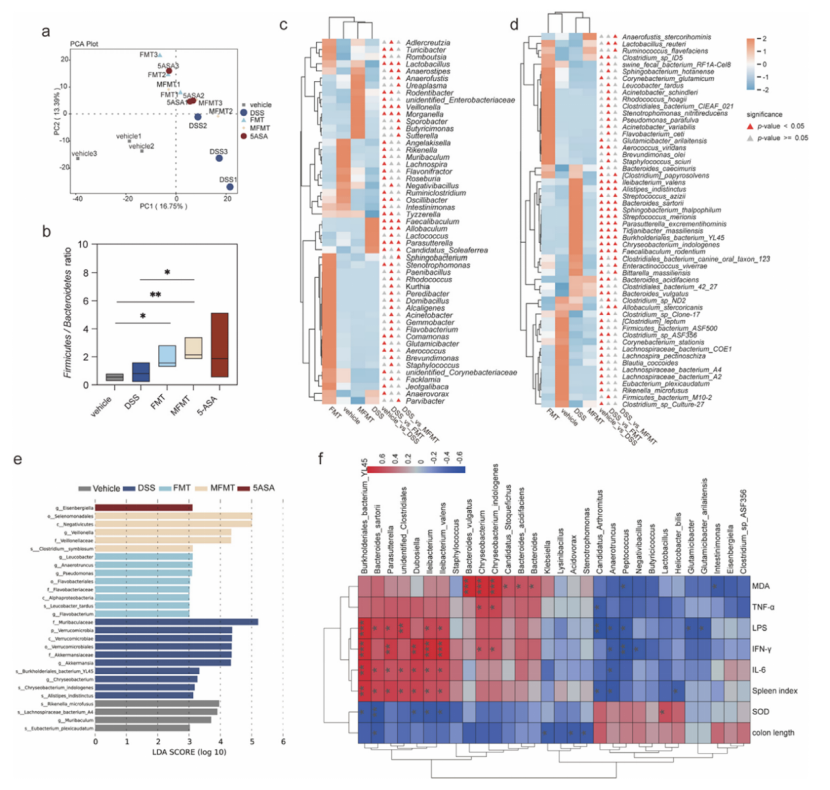
图4 改良供体微生物群的肠菌移植对DSS诱导的结肠炎小鼠肠道微生物群的影响
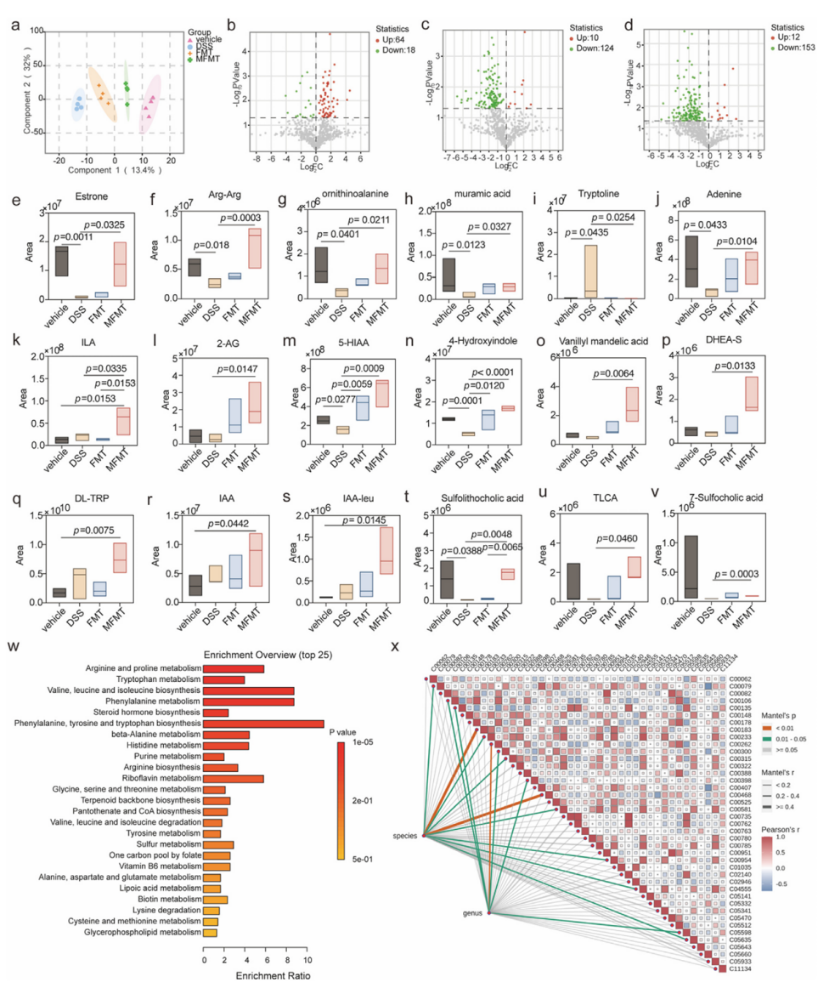
图5 代谢组学分析研究为什么改良的肠菌移植在缓解DSS诱导的结肠炎方面比传统的粪便微生物群落移植更有效
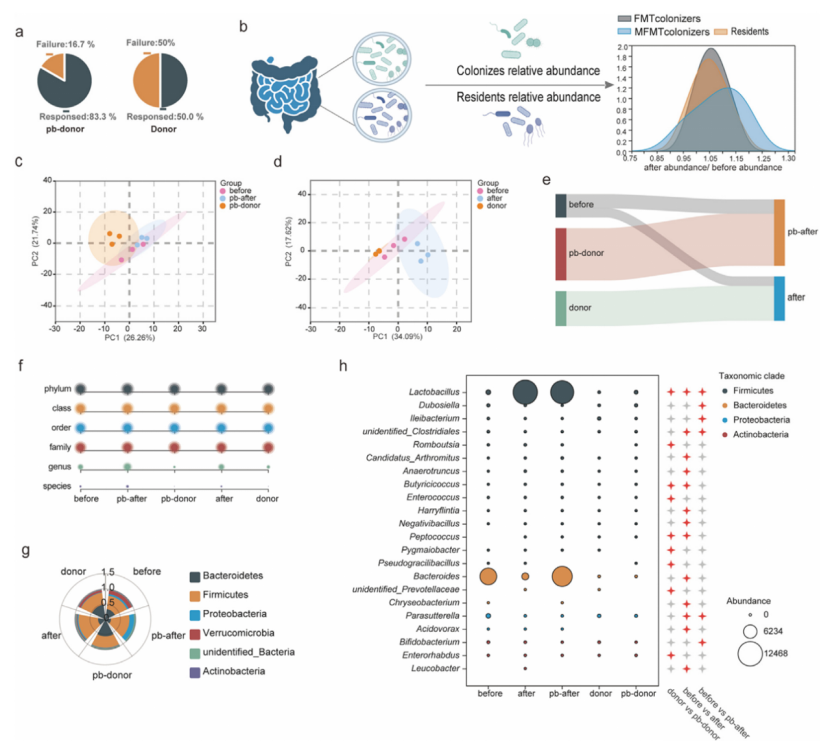
图6 不同供体对移植后小鼠肠道菌群定植和反应率的影响

03
讨论
Discuss
1.三维度验证MFMT的多靶点调控机制
将益生菌改造供体的作用归结为“三重优化 ”范式——生态位工程驱动(产酸富集丁酸菌)、代谢重塑激活免疫-菌群轴(色氨酸代谢激活AHR通路)和胆汁酸重塑(恢复肠屏障功能),系统阐释了MFMT的多维度协同机制。
2.研究局限与展望
尽管本研究基于动物模型,但其机制明确、疗效显著。未来亟需临床试验验证其在IBD患者中的应用价值。此外,该研究揭示了益生菌预处理通过“调环境、促免疫、改代谢、提适应”多个层面提升FMT的效果。这一策略不再依赖“运气好”的供体,而是用可控的方式优化供体菌群功能,为微生态疗法的“标准化、精准化、可推广”提供了全新思路。未来可发展“个性化MFMT ”策略,即根据患者基线菌群特征定制益生菌与供体,以实现疗效最大化。










